單抗藥物如何攻克阿爾茨海默癥 靶點大揭秘_MedChemExpress(MCE 中國)

老年癡呆!它還有個洋氣的名字——阿爾茨海默癥。一種常見的神經退行性疾病,病理現象主要涉及 β-淀粉樣蛋白斑塊、神經纖維纏結、神經元喪失和炎癥反應等。近年來,其對應靶點的治療藥物也層出不窮……
Aducanumab 在 2021 年 6 月 7 日獲得 FDA 加速批準上市,是第一個被 FDA 批準用于 AD 的新藥,用于 AD 源性輕度認知障礙 (MCI) 及輕度 AD 的治療。2023 年 1 月 6 日,FDA 批準 Lecanemab 上市,用于治療伴有輕度認知功能障礙或輕度癡呆的早期 AD。這標志著利用單抗藥物作為阿爾茨海默癥治療手段的可行性得到了認可。
本期小 M 就為大家盤點下都有哪些治療阿爾茨海默癥的單抗藥物!
Section.01
靶向 β-淀粉樣蛋白 (Aβ) 的
單抗藥物
淀粉樣蛋白前體蛋白 (APPs) 是天然存在于大多數組織中的跨膜蛋白。α-分泌酶將 APP 裂解成可溶性肽。然而,通過 β 分泌酶和隨后的 γ 分泌酶,產生淀粉樣蛋白 β 單體 Aβ1-40 和 Aβ1-42,然后形成低聚物和大聚合物。β 淀粉樣蛋白以多種形式存在,例如單體、寡聚體、原纖維和原纖維。寡聚體和原纖維具有神經毒性。淀粉樣蛋白級聯假說 (ACH) 規定,越來越多的聚集細胞外 Aβ,特別是可溶性寡聚物,具有神經毒性,促進 tau 蛋白分解,并形成神經原纖維纏結。這導致神經元死亡,表現為臨床前疾病,最終發展為阿爾茨海默癥。
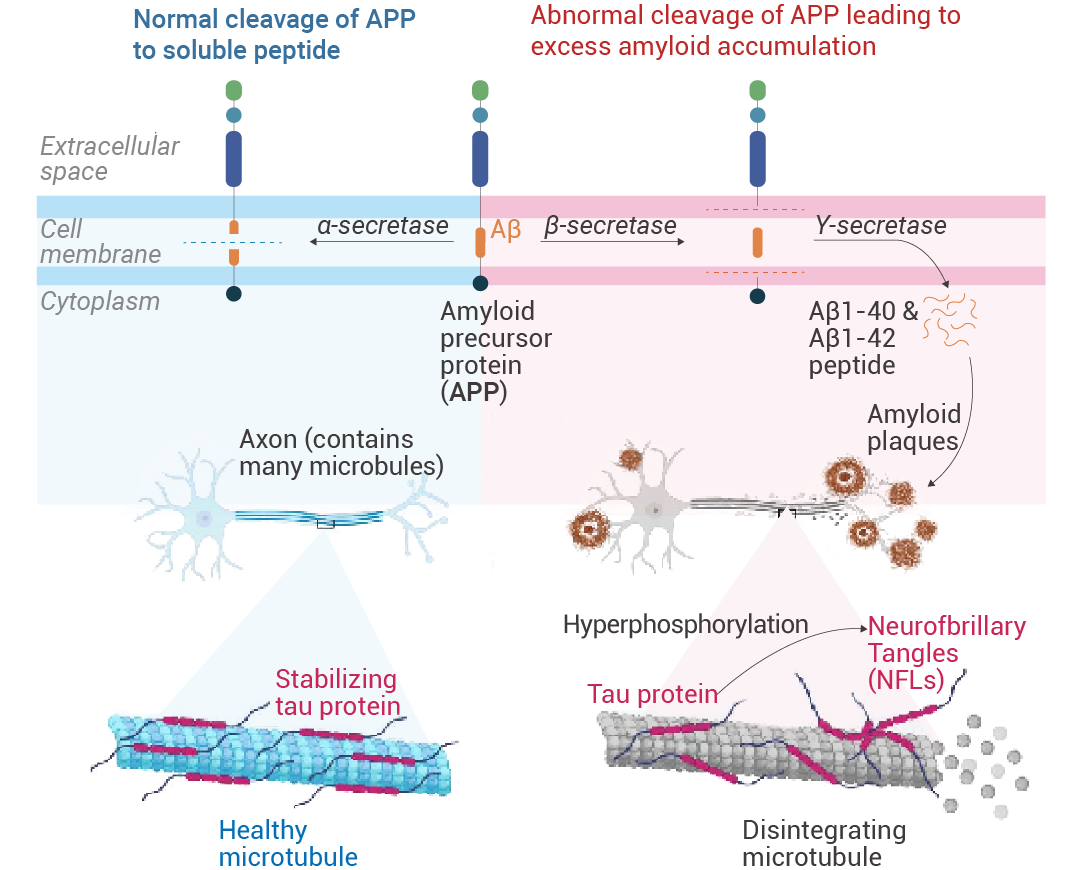
圖 1. 阿爾茨海默癥的病理生理學[1]。
Aducanumab (阿杜那單抗) 是一種高親和力、靶向- Aβ 構象表位的全人 IgG1 單克隆抗體。它能夠有選擇性地與 AD 患者大腦中的淀粉樣蛋白沉積結合,然后通過激活免疫系統,將大腦中的沉積蛋白清除。
Aducanumab 于 2021 年 6 月在美國獲 FDA 批準上市,是自 2003 年以來獲批用于治療阿爾茨海默癥的新療法。在臨床前研究中,Aducanumab 可以穿透血腦屏障,靶向淀粉樣斑塊并將其從轉基因小鼠大腦中清除。Aducanumab 臨床研究在 3,482 名阿爾茨海默病患者中進行,分為三項獨立的研究,包括雙盲、安慰劑對照、隨機和劑量范圍方式。臨床評估結果表明,接受治療的患者 Aβ-淀粉樣蛋白在劑量和時間依賴性方面顯著減少,而對照組患者的 Aβ-淀粉樣蛋白斑塊沒有減少。
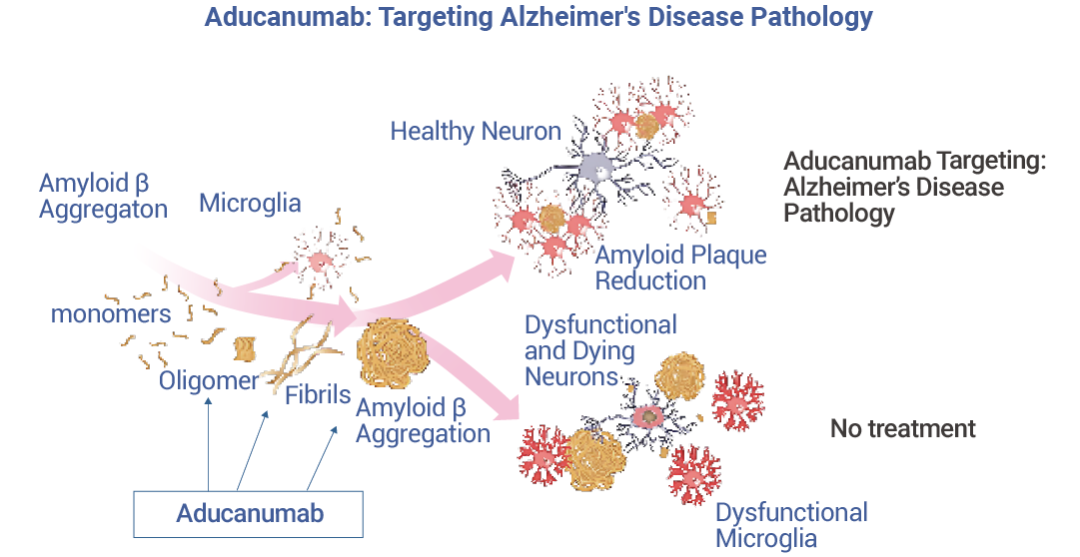
圖 2. Aducanumab 的作用機制[2]。
Lecanemab (侖卡奈單抗) 是鼠抗體 mAb158 的人源化 IgG1 形式,已被證明可降低致病性 Aβ,防止 Aβ 沉積,并特異性地減少 AD 動物模型中大腦和 CSF 中的 Aβ 原纖維。Aβ 原纖維的選擇性靶標將 Lecanemab 與其他抗淀粉樣蛋白 mAb 區分開來。Lecanemab 是有效的第二代單克隆抗體,用于免疫耗竭 Aβ 原纖維,尤其是可溶性原纖維和寡聚體。Lecanemab 結合可溶性原纖維的親和力是 Aducanumab 的 100 倍,與不溶性原纖維的親和力是 25 倍,對單體的結合親和力較低。2023 年 7 月美國 FDA 全面批準它用于治療阿爾茨海默病 (AD) 導致的輕度認知功能損害和早期癡呆。
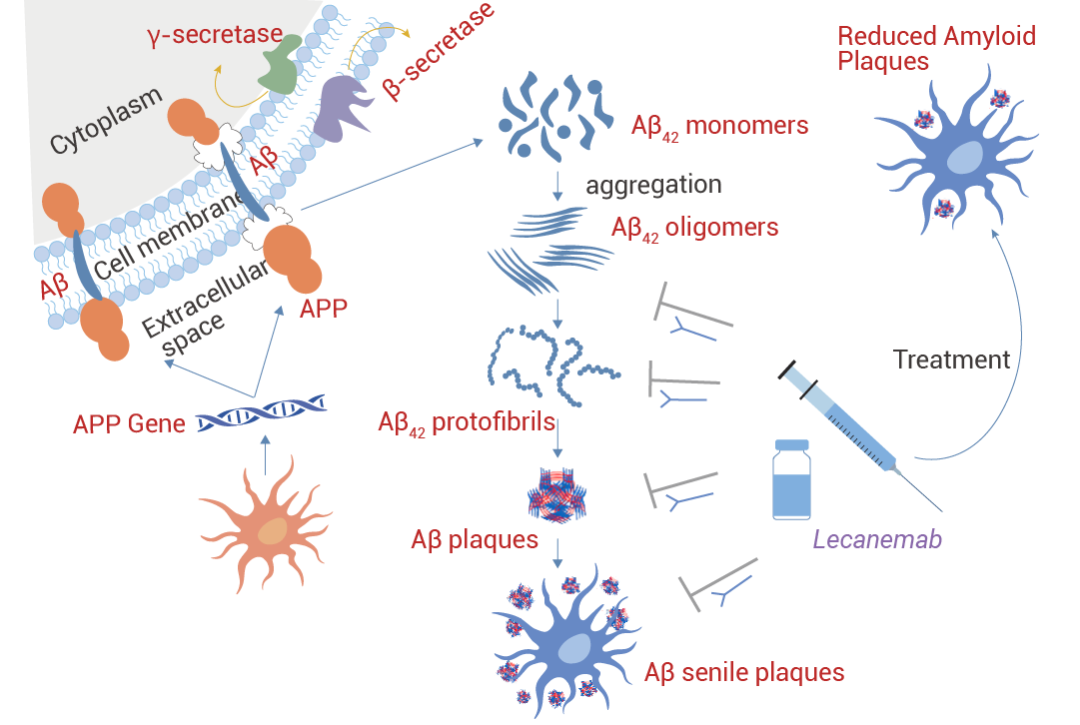
圖 3. Lecanemab 的作用機制[3]。
Donanemab (多奈單抗) 是人源化 IgG1 抗體,靶向 N 端 Aβ 表位,并通過小膠質細胞介導的吞噬作用幫助去除斑塊。Donanemab 的開發旨在通過小膠質細胞介導的吞噬作用去除現有的淀粉樣蛋白斑塊。在老年淀粉樣蛋白前體蛋白轉基因小鼠中施用 Donanemab 可導致劑量依賴性斑塊減少,而無微出血傾向。Donanemab 不與其他 Aβ 物種、神經遞質或其受體的脫靶結合,并且沒有已知的癥狀效應。
Bapineuzumab (巴匹珠單抗) 是小鼠單克隆抗體 3D6 的人源化形式,靶向 Aβ 的 N 端區域。這種被動免疫療法的基本原理是抗體結合會清除過量的 Aβ。支持 Bapineuzumab 的臨床前研究中,有很大一部分是通過 3D6 評價的。研究表明,外周給藥的一小部分抗體進入了中樞神經系統。該抗體能與淀粉樣蛋白斑塊結合,降低斑塊負荷,改善突觸毒性測量,并改善小鼠行為測定的表現。此外,II 期臨床試驗表明,Bapineuzumab 可以降低正電子發射斷層掃描 (PET) 上淀粉樣蛋白的負荷和腦脊液中磷酸化 tau 蛋白的濃度。
Solanezumab (索拉珠單抗) 是一種針對 Aβ 肽中間結構域的人源化單克隆 IgG1 抗體。它識別可溶性單體 Aβ,而不是原纖維 Aβ。在臨床前研究中,單次注射 M266 (Solanezumab 的小鼠版本) 可逆轉 APP 轉基因小鼠模型中的記憶缺陷,同時保留淀粉樣蛋白斑塊,提高了靶向 Aβ 可溶性庫的可能性。臨床前阿爾茨海默病患者的 3 期試驗中,Solanezumab 靶向腦淀粉樣蛋白水平升高患者的單體淀粉樣蛋白。但與安慰劑相比,Solanezumab 在 240 周的時間內并沒有減緩臨床前阿爾茨海默病患者的認知能力下降。
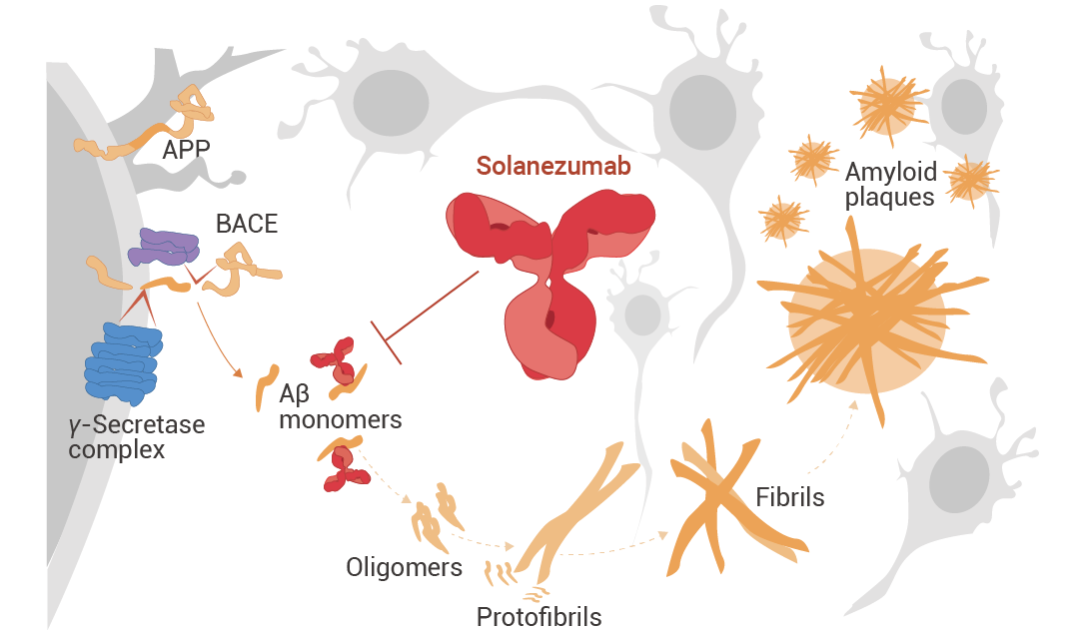
圖 4. Solanezumab 的作用機制[4]。
Gantenerumab (更汀蘆單抗) 是一種全人源 IgG1 抗體,以亞納摩爾親和力結合 Aβ 原纖維上的構象表位。它包含 Aβ 的 N 末端和中心氨基酸。該抗體通過募集小膠質細胞和激活吞噬作用,集中作用以分解和降解淀粉樣蛋白斑塊。Gantenerumab 優先與聚集的腦 Aβ 相互作用,包括實質和血管。它還中和寡聚 Aβ42 介導的對大鼠大腦長期增強的抑制作用。在 APP/PS-1 轉基因小鼠中,gantenerumab 與腦 Aβ 結合,通過募集小膠質細胞來減少小斑塊,并防止新斑塊的形成。
Crenezumab (克瑞組單抗) 是一種人源化 IgG4 抗體,可識別多種形式的聚集 Aβ,包括具有高親和力的寡聚體和原纖維物種,以及低親和力的單體 Aβ。與 IgG1 相比,Crenezumab 的 IgG4 骨架賦予減少的 FcγR 激活,并被證明可以最大限度地減少 FcγR 介導的小膠質細胞炎癥激活。Crenezumab 刺激淀粉樣蛋白吞噬作用,同時限制炎性細胞因子的釋放,以避免血管源性水腫等副作用。值得注意的是,Crenezumab 螯合了 Aβ 的疏水核心,打破了 β-hairpin 構象的基本鹽橋特征,消除了 Aβ 寡聚體和原纖維中基本特征。
Section.02
靶向 tau 蛋白的單抗藥物
tau 是由 352-441 個氨基酸形成的中樞神經系統重要蛋白,由 17 號染色體上的 MAPT 基因編碼,可產生 6 種亞型。tau 的主要功能是促進神經元軸突中微管的組裝和穩定。tau 與微管的結合受其磷酸化/去磷酸化平衡的調節。在生理條件下,tau 被展開和磷酸化,而病理形式的特征是過度磷酸化導致從微管脫離,以及構象變化導致形成異常磷酸化 tau 的成對螺旋和直絲,隨后形成 tau 聚集體。這些聚集體會導致神經元和神經膠質細胞退化,最終導致各種臨床認知、行為和運動表現,這些表現被歸類為不同類型的神經退行性疾病,稱為 “tau 蛋白病”。
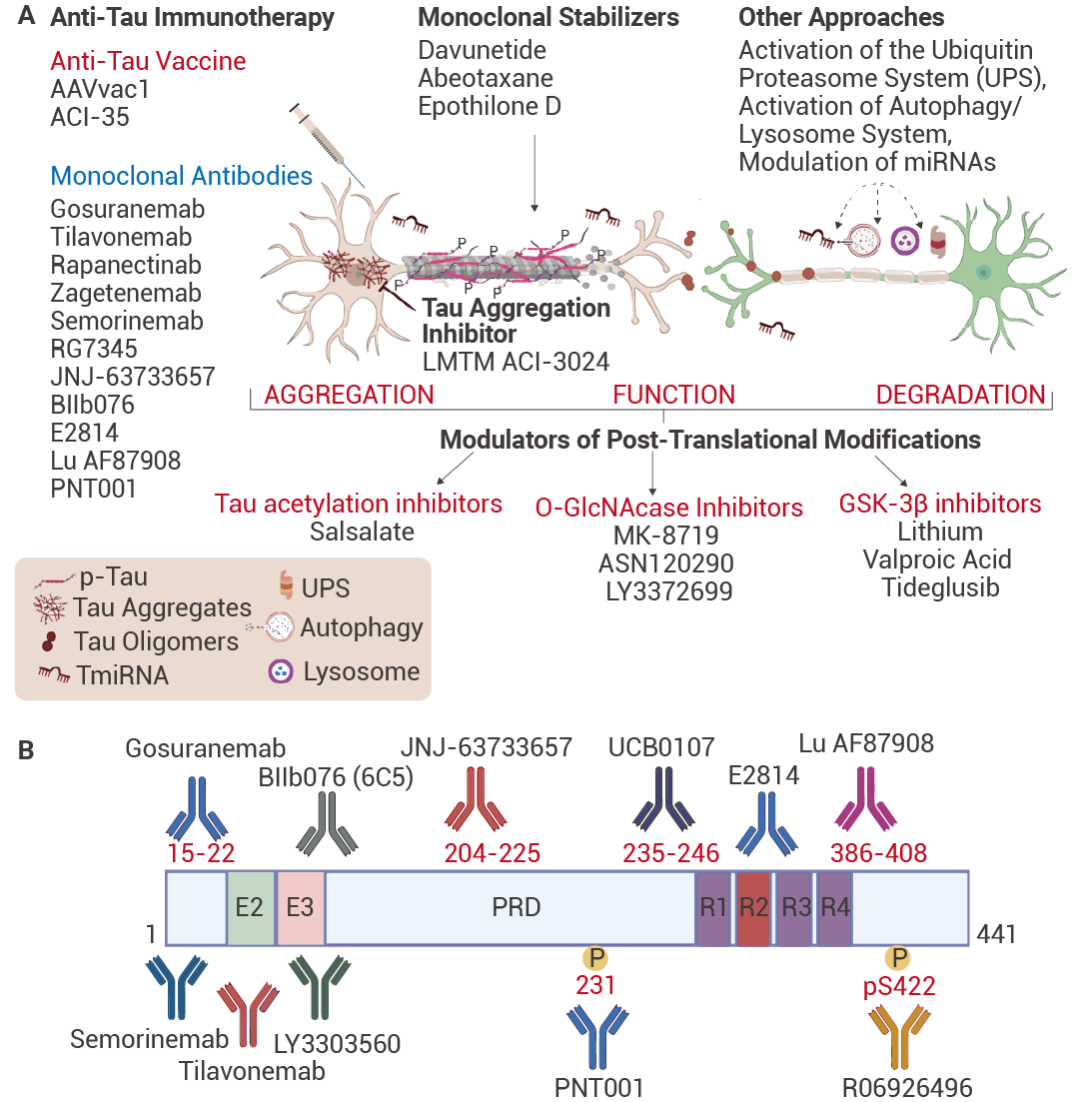
圖 5. 對于目前正在臨床試驗中的 tau 蛋白抗體藥物[5]。
Gosuranemab (戈奈單抗) 是一種人源化 IgG4 單克隆抗 tau 抗體,靶向細胞外 tau N 端片段 (eTau),這些片段最初是從家族性 AD 患者來源的多能干細胞中分離的。eTau 被認為參與 tau 蛋白病病理學的傳播,Gosuranemab 在額顳葉癡呆小鼠模型中中和 eTau 的毒性。結合實驗表明,Gosuranemab 對來自不同 tau 蛋白病的 tau 單體、tau 原纖維和不溶性 tau 表現出高親和力。使用 X 射線晶體學和誘變進行的表位定位研究表明,Gosuranemab 與人 tau15-22 殘基結合。
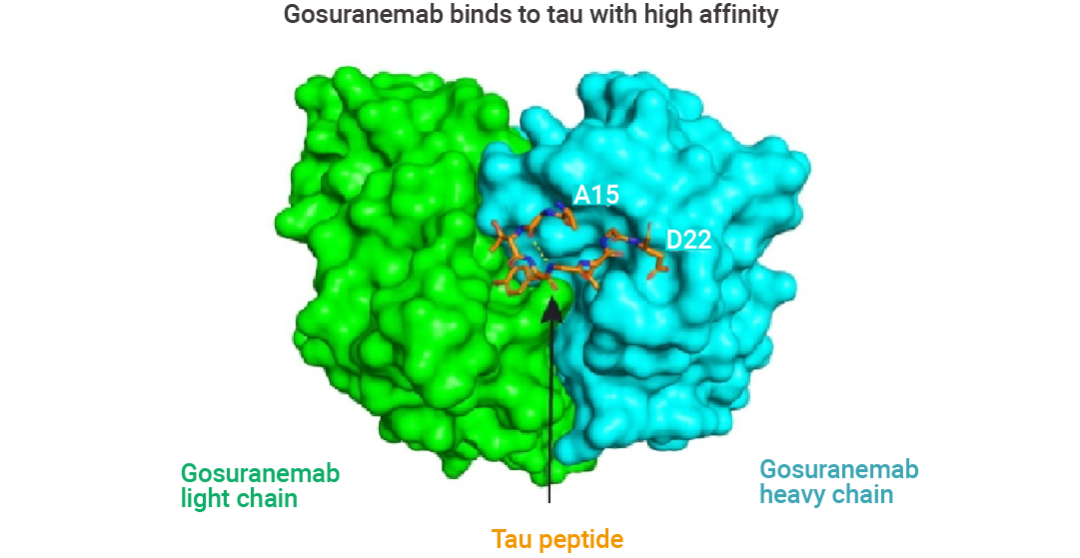
圖 6. Gosuranemab 與 tau 的晶體結構[6]。
青色表示重鏈,綠色表示輕鏈,橙色表示 tau 肽。
Semorinemab (西瑞奈單抗) 是一種 IgG4 單克隆抗 tau 抗體,結合人 tau 的所有六種亞型的 N 端,包括單體和寡聚體,在神經元和小膠質細胞共培養中能夠保護神經元免受 tau 寡聚體神經毒性的影響。此外在轉基因小鼠 tau 病變模型中,小鼠版本的 Semorinemab 每周一次腹膜內給藥 13 周后,減少 tau 病理的積累,與抗體效應功能狀態無關。在 1 期臨床試驗中,單劑量高達 16,800 mg,一個月內多劑量總計 33,600 mg,沒有觀察到令人擔憂的安全信號。與健康對照參與者相比,AD 參與者在服藥后觀察到系統性 tau 濃度更高。
Tilavonemab (替拉奈單抗) 是一種人源化 IgG4 抗體,它識別一種聚集的細胞外病理性 tau 形式,與 tau 的 N 端結合。Tilavonemab 與其他一些抗 tau 抗體的不同之處在于,其作用機制不需要被神經元攝取。在 P301S tau 轉基因小鼠中,Tilavonemab 可以減少腦神經原纖維病理、不溶性 tau、小膠質細胞增生、處理過的腦裂解物的接種活性和條件性恐懼反應的缺陷。在一項 1 期單次遞增劑量研究 (NCT02494024) 和一項 2 期隨機安慰劑對照試驗 (NCT02985879) 中,Tilavonemab 耐受性良好,但未對患者有效。
Zagotenemab (澤格特奈單抗) 是人源化 IgG4 抗體,靶向源自 MCI-1 的 tau 的 7-9 和 312-342 個氨基酸。Zagotenemab 結合并中和可溶性 tau 聚集體。在臨床前研究中,通過涉及轉基因小鼠和非人靈長類動物的研究,突出了 Zagotenemab 親本抗體的療效。當轉基因小鼠用 MCI-1 處理時,觀察到磷酸化 tau 水平和神經原纖維病理顯著降低。這種效應歸因于 tau/抗體復合物的清除,由小膠質細胞依賴性或神經元依賴性機制。此外,與單體相反,它表現出與 tau 聚集體的選擇性和高親和力結合。在非人靈長類動物中,Zagotenemab 在血清中的半衰期為 13 天,清除率為 0.15 mL/h/kg。
Bepranemab (貝瑞奈單抗) 是一種人源化單克隆 IgG4 抗體,與 tau 的中心區域結合,識別 tau 微管結合結構域附近的 235-250 氨基酸。與 N 末端靶向的抗 tau 抗體相比,Bepranemab 更干擾致病性聚集性 tau 的細胞間傳播與靶向 tau N 端區域的抗體相比,靶向 tau 中區的抗體似乎更有可能破壞病原性和聚集的 tau 在細胞之間的傳遞。在轉基因小鼠的實驗中,它成功地避免了通過注射源自阿爾茨海默病腦提取物的 tau 誘導的 tau 病理學的發作。此外,它還證明了阻止 tau 病理學傳播到遠處大腦區域的能力。另一個重要方面是其人 IgG4 種型,表明消除與抗體結合的 tau 可能不依賴于小膠質細胞吞噬作用。這種特征為其在減輕與 tau 蛋白相關的神經退行性病變引入了額外的復雜性。
Posdinemab (JNJ-63733657) 是一種人源化 IgG1 單克隆抗體,結合富含脯氨酸的 tau 結構域。與靶向 tau 的 N 端的抗體相比,Posdinemab 更能有效地干擾致病性聚集的 tau 的細胞間傳播。它對在殘基 217 處磷酸化的 tau 具有高親和力。Posdinemab 可在基于細胞的測定中消除致病性 tau“種子”,并抑制小鼠模型中 tau 病理學的擴散。
MCE 為廣大客戶提供高質量,高純度的抗體抑制劑產品,包括:單克隆抗體、雙特異性抗體、融合蛋白、大鼠/小鼠體內抗體、同型對照抗體等,經 SDS-PAGE,SEC-HPLC 驗證純度大于 95%,內毒素小于 1 EU/mg,可用于體內研究。
產品推薦 |
β-Amyloid (25-35) HY-P0128 β-Amyloid (25-35) (Amyloid beta-peptide (25-35)) 是阿爾茨海默氏淀粉樣蛋白 β 肽的 Aβ (25-35) 片段,在培養細胞中顯示出神經毒性活性。 |
β-Amyloid (1-42), human HY-P1363A β-Amyloid (1-42), human (Amyloid β-peptide (1-42), human) 是由 42 個氨基酸組成的肽,其在阿爾茨海默病的發病機制中起關鍵作用。 |
Lecanemab (Mouse IGG2a) HY-P990110 Lecanemab (Mouse IGG2a) 是一種靶向可溶性 β-amyloid 的單克隆抗體,具有減輕認知下降的作用。 |
Semorinemab HY-P99399 Semorinemab (RG 6100) 是一種抗 Tau 人源化 IgG4 單克隆抗體,靶向 Tau 蛋白的 N 端部分 (氨基酸殘基 6-23)。 |
Gantenerumab HY-P99022 Gantenerumab 是一種人源的抗淀粉樣蛋白-β (Aβ) IgG1 單克隆抗體,顯示出持續的腦淀粉樣蛋白-β 結合。 |
Aducanumab HY-P9967 Aducanumab (BIIB037) 是一種選擇性靶向聚集的 β 淀粉樣蛋白 (Aβ) 的人單克隆抗體。 |
Bapineuzumab HY-P99185 Bapineuzumab 是一種抗 β-淀粉樣蛋白 (APP) 單克隆抗體。Bapineuzumab 可用于阿爾茨海默病 (AD) 的研究。 |
Bepranemab HY-P99471 Bepranemab (UCB 0107) 是一種人源化全長 IgG4 單克隆抗體。Bepranemab 靶向 tau 蛋白的中心部分,特別是 235 至 246 位氨基酸。Bepranemab 可用于阿爾茨海默病 (AD) 研究。 |

[1] Qi X, et al. Disease Modifying Monoclonal Antibodies and Symptomatic Pharmacological Treatment for Alzheimer's Disease. Biomedicines. 2024 Nov 19;12(11):2636.
[2] Esang M, et al. Aducanumab as a Novel Treatment for Alzheimer's Disease: A Decade of Hope, Controversies, and the Future. Cureus. 2021 Aug 31;13(8):e17591.
[3] Chowdhury S, et al. Novel anti-amyloid-beta (Aβ) monoclonal antibody lecanemab for Alzheimer's disease: A systematic review. Int J Immunopathol Pharmacol. 2023 Jan-Dec;37:3946320231209839.
[4] Sperling RA, et al. Trial of Solanezumab in Preclinical Alzheimer's Disease. N Engl J Med. 2023 Sep 21;389(12):1096-1107.
[5] Imbimbo BP, et al. Initial failures of anti-tau antibodies in Alzheimer's disease are reminiscent of the amyloid-β story. Neural Regen Res. 2023 Jan;18(1):117-118.
[6] Sopko R, et al. Characterization of tau binding by gosuranemab. Neurobiol Dis. 2020 Dec;146:105120.

免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號
















 采購中心
采購中心